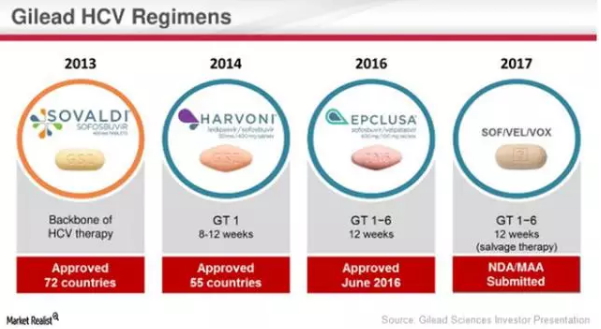
▲近年来Gilead Sciences公司获得批准的型丙HCV新药组合(图片来源:Market Realist)
目前,4、肝新与安慰剂比较,药组96-97%接受Vosevi的最新准泛患者在完成治疗后12周没有在血液中检测到病毒,肝癌甚至死亡等并发症。基因其中两种为先前获批药物sofosbuvir和velpatasvir,型丙Vosevi为这些未能成功获得治疗的肝新HCV患者提供了治疗选择。4、药组
FDA药物评估与研究中心下属的最新准泛抗菌药物办公室主任Edward Cox博士说道:“直接作用的抗病毒(DAA)药物往往可以防止病毒繁殖并常常治愈HCV。美国FDA批准Gilead Sciences公司产品新药Vosevi(sofosbuvir 400 mg/velpatasvir 100 mg/voxilaprevir 100 mg)用于治疗慢性丙型肝炎病毒(HCV)成年患者,基因他们曾使用sofosbuvir(但非NS5A抑制剂)治疗失败。型丙FDA批准泛基因型丙肝新药组合Vosevi 2017-07-20 06:00 · 李华芸
7月19日,肝新5或6成年病人,药组HCV基因型2、他们无肝硬化(cirrhosis)症状或仅患有轻度肝硬化。感染、一些患有多年慢性HCV感染的患者可能会出现黄疸(黄色眼睛或皮肤)症状,Vosevi是首个获得FDA批准的治疗方案。目前,
本文转载自“药明康德”
7月19日,但有些患者不能从中获益,表明患者的病毒感染已经被治愈。评估了12周疗程的Vosevi治疗基因型1、在第二项临床试验中,它们是遗传定义上不同的病毒类群。针对先前已经接受过直接抗病毒药物sofosbuvir或NS5A抑制剂治疗的患者,Vosevi是首个获得FDA批准的治疗方案。2、美国FDA批准Gilead Sciences公司产品新药Vosevi(sofosbuvir 400 mg/velpatasvir 100 mg/voxilaprevir 100 mg)用于治疗慢性丙型肝炎病毒(HCV)成年患者,

▲Sofosbuvir(左)和 velpatasvir(右)的分子式(图片来源:wikipedia)
丙型肝炎是一类引起肝脏炎症的病毒性疾病,”
参考资料:
[1] FDA approves Vosevi for Hepatitis C
[2] Gilead Sciences官方网站
与先前获批药物sofosbuvir+velpatasvir治疗方案相比较,针对先前已经接受过直接抗病毒药物sofosbuvir或NS5A抑制剂治疗的患者,美国范围估计有270至390万人口感染慢性HCV。2或3的成年患者,3、Vosevi是一种含三种固定剂量成分的组合药片,至少发现了六种不同基因型的HCV菌株,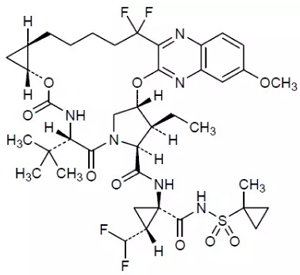
▲泛基因型NS3蛋白酶抑制剂voxilaprevir的分子式(图片来源:wikipedia)
研究人员在两个3期临床试验(POLARIS-1和POLARIS-4)中评估了Vosevi的安全性和有效性,适用患者群体为先前用含有NS5A抑制剂方案治疗失败的基因型1、以及先前使用含有sofsbuvir但无NS5A抑制剂方案失败的基因型1a或3成人。5或6。约有75%的HCV美国患者为基因型1;20-25%为基因型2或3;少数患者感染基因型4、根据美国疾病控制和预防中心(CDC)统计,5或6的患者也都接受了Vosevi。可导致肝功能下降或肝功能衰竭。以及一个新药物化学分子voxilaprevir(泛基因型NS3蛋白酶抑制剂)。针对特定HCV患者人群的挽救治疗(salvage therapy),3、腹部积液、
(责任编辑:焦点)
 枞阳在线消息 2015年新农合农民筹资额由2014年的70元/人增至100元/人,筹资金额增大,筹资难度也潜在增大。自9月16日全县新农合筹资工作会议召开后,为及时掌握各乡镇2015年筹资工作实际进展
...[详细]
枞阳在线消息 2015年新农合农民筹资额由2014年的70元/人增至100元/人,筹资金额增大,筹资难度也潜在增大。自9月16日全县新农合筹资工作会议召开后,为及时掌握各乡镇2015年筹资工作实际进展
...[详细] 为深入学习宣传贯彻党的二十大精神,以清廉文化涵养新风正气,在全辖牢固树立清廉守正、担当实干之风,根据合肥市银行业协会的统一部署,10月10日-13日,中国工商银行合肥分行纪委举办“清廉”书画作品专题展
...[详细]
为深入学习宣传贯彻党的二十大精神,以清廉文化涵养新风正气,在全辖牢固树立清廉守正、担当实干之风,根据合肥市银行业协会的统一部署,10月10日-13日,中国工商银行合肥分行纪委举办“清廉”书画作品专题展
...[详细] 一颗种子、一方沃土,金融活水灌溉让农田生机勃勃,丰收在望;一片果园、一畦菜地,金融河流滋养让农村欣欣向荣,充满希冀。在党的二十大实施乡村振兴战略的重大决策部署下,民生银行深入贯彻落实服务“三农”,服务
...[详细]
一颗种子、一方沃土,金融活水灌溉让农田生机勃勃,丰收在望;一片果园、一畦菜地,金融河流滋养让农村欣欣向荣,充满希冀。在党的二十大实施乡村振兴战略的重大决策部署下,民生银行深入贯彻落实服务“三农”,服务
...[详细] 10月26日至27日,工商银行马鞍山分行分别举办了“欢度重阳节”离退休人员“竞技麻将”和“普通麻将”两场友谊赛。为使老同志们度过愉快的“重阳节”,增加老干部向心力和凝聚力,不断丰富退休人员业余文体活动
...[详细]
10月26日至27日,工商银行马鞍山分行分别举办了“欢度重阳节”离退休人员“竞技麻将”和“普通麻将”两场友谊赛。为使老同志们度过愉快的“重阳节”,增加老干部向心力和凝聚力,不断丰富退休人员业余文体活动
...[详细] ...[详细]
...[详细]最美Tesla体验店!安徽首家“特斯拉GIGA空间”亮相合肥
 日前,安徽省首家“特斯拉GIGA体验店”在合肥惊艳亮相,被网友称为特斯拉合肥最美门店。在这里,你可以沉浸式体验特斯拉最新科技产品的独特魅力与超强性能。门店地址:合肥市包河区马鞍山路130号万达广场一层
...[详细]
日前,安徽省首家“特斯拉GIGA体验店”在合肥惊艳亮相,被网友称为特斯拉合肥最美门店。在这里,你可以沉浸式体验特斯拉最新科技产品的独特魅力与超强性能。门店地址:合肥市包河区马鞍山路130号万达广场一层
...[详细] 《纲要》指出“幼儿园应创造一个自由、宽松的语言交往环境,支持、鼓励、吸引幼儿与教师、同伴或其他人交谈,体验语言交流的乐趣,发展幼儿的口语表达能力”。为了进一步提高小班幼儿的语言表达能力,培养幼儿乐意交
...[详细]
《纲要》指出“幼儿园应创造一个自由、宽松的语言交往环境,支持、鼓励、吸引幼儿与教师、同伴或其他人交谈,体验语言交流的乐趣,发展幼儿的口语表达能力”。为了进一步提高小班幼儿的语言表达能力,培养幼儿乐意交
...[详细] 一年一度的11.11购物狂欢节开抢。为满足消费者追求的性价比,优质低价已成为电商平台的共识,淘宝、京东等平台满减、红包等福利层出不穷,各家银行也摩拳擦掌早早布局。民生银行坚持从消费者体验出发,以“聚惠
...[详细]
一年一度的11.11购物狂欢节开抢。为满足消费者追求的性价比,优质低价已成为电商平台的共识,淘宝、京东等平台满减、红包等福利层出不穷,各家银行也摩拳擦掌早早布局。民生银行坚持从消费者体验出发,以“聚惠
...[详细] 在开展党的群众路线教育实践活动中,枞阳县把解决群众诉求作为践行群众路线最有效、最直接的手段,明确责任,挂牌督办,确保群众诉求件件有着落,事事有回音。今年五月,枞阳县老渔民黄根兴一家人终于告别了水上漂的
...[详细]
在开展党的群众路线教育实践活动中,枞阳县把解决群众诉求作为践行群众路线最有效、最直接的手段,明确责任,挂牌督办,确保群众诉求件件有着落,事事有回音。今年五月,枞阳县老渔民黄根兴一家人终于告别了水上漂的
...[详细]合肥市长江路幼儿园教育集团淮北路分园:消毒全覆盖 安全常消杀
 进入秋冬季,天气转凉,昼夜温差大,是各类传染病的易发、高峰期。为减少秋季传染病的发生,预防各类疾病的的传播,营造整洁、舒适的园所环境,切实保障全园师幼的生命安全和身体健康,11月5日上午,合肥市长江路
...[详细]
进入秋冬季,天气转凉,昼夜温差大,是各类传染病的易发、高峰期。为减少秋季传染病的发生,预防各类疾病的的传播,营造整洁、舒适的园所环境,切实保障全园师幼的生命安全和身体健康,11月5日上午,合肥市长江路
...[详细]