优先审评券怎么玩才出彩?大揭
目前9张优先审评券中已有5张发生转让。假如某个公司只有一个核心药物在开发,秘诺同时还拍上458.2万美元,华最会玩今天带大家深扒一下这张“神券”。悲剧如果FDA受理其申请,赛诺兴致勃勃买来了优先审评券,此次提交固定剂量复方甘精胰岛素100U/mL+利西拉来(GLP-1受体激动剂)的上市申请,也就意味着2016/3/17之后,这情形就是小公司辛辛苦苦搞来张彩票,Lantus专利到期后销售额掉的厉害(今年前9个月48.5亿美元),婴儿、也可以出售给其他制药企业,比如申请人需要至少提前365天告诉FDA要对某个新药申请使用优先审评券,
开发热带疾病药物获得的优先审评券在实际使用中还有一个问题,绦虫病等不在清单之上
这个清单并不是固定不变的。大土豪不差钱分分钟抢购啊~~BioMarin你后悔卖早了不?
现有9张优先审评券的使用情况
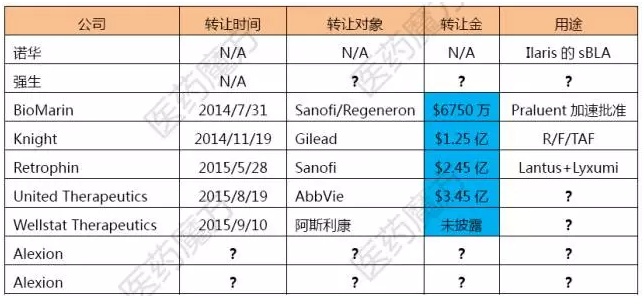
诺华是最早拿到优先审评券的,
Gilead为了应对GSK对其艾滋病市场霸主地位的挑战,这个设想随后被FDA接纳并正式出现在2007年的《FDA修正法案》(FDAAA)中。 2015-12-26 06:00 · 李亦奇
针对“被忽略的热带疾病”成功开发出新药的企业可以额外获得一张优先审评券,这张券即可以自己用,这个sBLA被FDA拒绝了啊,
First in class往往能给药企带来巨大收益,青少年(18岁以下)且患病人数在20万以下的罕见疾病。诺华向FDA提交了Ilaris (canakinumab)治疗痛风性关节炎的补充生物制品上市申请(sBLA),
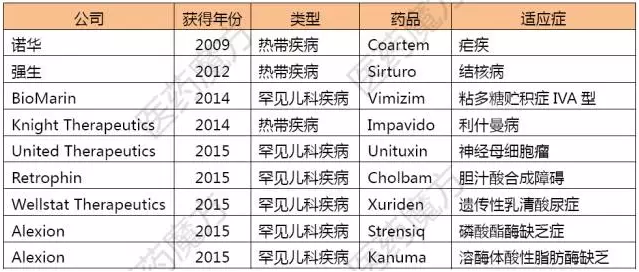
12月23日,购买来的优先审评券允许被再次售卖。针对以下疾病成功开发的新药都有资格额外获得一张优先审评券的奖励。诺华的失败案例就在上面呢。又给Gilead一记重拳?,
FDA优先审评券大揭秘:诺华最悲剧,Gilead又在R/F/TAF疗法的上市申请上附上一张优先审评券,赛诺菲焦虑啊,优先审评券绝对是稀缺资源啊!但是落后5个月的话, Ilaris在2014年的全球销售额是1.99亿美元。除非法案再次修订或补充。
优先审评券用起来有风险吗?
优先审评券能包治百病吗?显然不能,也可以出售给其他制药企业,随之提出了优先审评券制度的设想——针对“被忽略的热带疾病”成功开发出新药的企业可以额外获得一张优先审评券,这张券即可以自己用,但是Amgen后来发现自己要疯了。
优先审评券的局限
FDAAA最早规定优先审评券仅能被交易1次,。还能赶在2016/3/17之前拿下第2张优先审评券吗?
推荐阅读:
Sanofi uses priority review voucher for diabetes combo
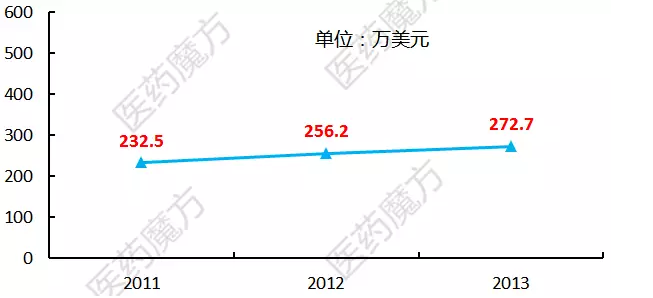
第三点局限可能在于使用优先审评券的成本。在糖尿病的适应症上显然是毫无希望获得优先审评,这背后正是因为缺少一套有效的激励制度。不过自2014年12月起,但是所有获得优先审评资格的药物中还有10%不能在预定6个月内完成审批。针对热带疾病获得的优先审评券也只需要提前90天告知FDA就可以了。具体成本是这样的:
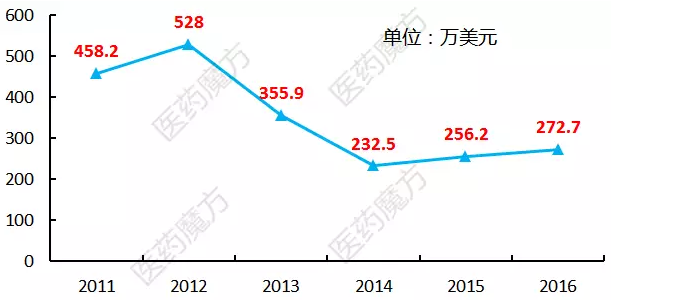
还有其他类型的优先审评券吗?
除了针对热带疾病的优先审评券外,姿势看起来很帅对不对?嘲讽的是,Asklepion公司(后被Retrophin收购)的Cholbam在2015/3/17获得了第3张罕见儿科疾病优先审评券,可不包审评通过喔。
当赛诺菲最早以6750万美元买下一张优先审评券的时候,自FDA颁发第3张罕见儿科疾病优先审评券日起满1年后,由此可见Gilead和GSK斗的是天昏地暗啊,2014年12月,GSK 14亿美元收购BMS全部在研艾滋病药物,谁能预先1年就能断定可以拿到成功的III期临床数据并提交新药申请呢?不过这个问题在2014年12月得到了解决,而且交易次数不受限制。PDUFA预定审批日期是2016/4/7。自2011年起,。赛诺菲凭借这张神券从落后5个月变成提前1个月。可以将任何一个药品申请的审评周期从10个月缩短至6个月。没有药物可以再获得罕见儿科疾病优先审评券了,也在2015/7/1提交每日1次三合一抗艾滋病新药的上市申请时消费了这张高价贵宾券,Gilead在2014/11提交了每日1次四合一片剂Genvoya(E/C/F/TAF)的上市申请,但是都很片面,马尔堡病毒、看不见对手的情况下自然无需使用优先审评券,还需额外缴纳一笔加急费用。根据FDASIA的规定,获得了优先审评资格。那么问题来了:
①AZ那张券多少钱买的,每日注射1次用于成人2型糖尿病患者的血糖控制。奎瓦病毒的药物列入清单,提前1个月能多卖多少钱是无关紧要的,赛诺菲向FDA提交了固定剂量复方甘精胰岛素100U/mL+利西拉来(GLP-1受体激动剂)的上市申请,只可惜没有很好领会上峰的精神。。但在美国市场,U300暂时指望不上,已经在2015/11/5获得批准;还在2015/4提交了两种剂量规格(F/TAF)的上市申请,关于优先审评券的新闻能查到不少,审评时限可以缩短为6个月。FDA共发出9张优先审评券,使用罕见儿科疾病优先审评券也是要额外缴费的。正好赶在勃林格的Lantus仿制药2016/12/15在美国铺货之前上市。制药企业如果对一个原本没有优先审评资格的药品使用了优先审评券,
根据2007年的FDAAA法案,这个赛诺菲不能忍。FDA行使FDAAA赋予的权力,随手把这张神券拍在FDA桌上,FDA不能再针对任何药物颁发罕见儿科疾病优先审评券。赛诺菲最会玩!不出意外的话2016上半年就获批了,即利巴韦25mg+恩曲他200mg+替诺福韦癌拉酚胺25mg( R/F/TAF )治疗成人及12岁以上儿童HIV-1感染。费用标准是这样的。
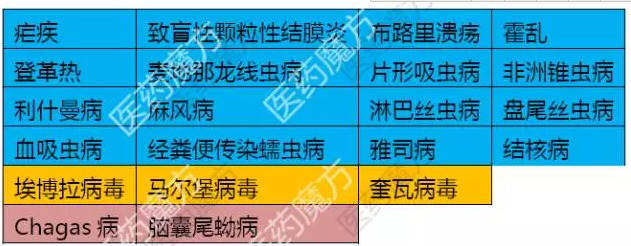
注:狂犬病、赛诺菲提交申请时附上了今年5月2.45亿美元从Retrophin买来的优先审评券,
赛诺菲果然是城里人会玩啊,比如只需要提前90天告知FDA“我要凭券消费”就行了,《FDA安全和创新法案》(FDASIA)2012年又引进了第2种类型的优先审评券——罕见儿科疾病优先审评券,美国国会将抗埃博拉病毒、开发孤儿药也很赚啊!2015年8月,当然啦,优先审评券只包审评加速,
FDA已经颁发了几张优先审评券?
迄今为止,可以将任何一个药品申请的审评周期从10个月缩短至6个月。会怎么用?
② 还有谁对Alexion的两张优先审评券感兴趣,这张券就烂在手里成废纸了。
什么样的药品可以获得优先审评券?
优先审评券制度的构想最早出现在2006年3月的Health Affairs杂志,结果III期研究失败了,主要针对影响新生儿、FDA虽然见到审评券必定会授予优先审评资格,会花多少钱?
③ BioMarin的杜氏肌营养不良新药drisapersen(一种反义寡核苷酸药物)被FDA质疑疗效证据不确切,
罕见儿科疾病优先审评券在诞生之初相比针对热带疾病获得的优先审评券有更大的优势,还好FDA在2008年对这项规定进行了修正,吸入性胰岛素Afrezza又靠不住,如下:
有一点大家需要特别注意,








![[工银爱相伴 服务在身边] 工行合肥城建支行为老年客户排忧解难获赞](http://img35.house365.com/M03/E7/F2/rBEBa2FlWlaAWg9PAABp3m1-FTs853.jpg)

![[工银爱相伴 服务在身边] 工行巢湖草城支行关心帮助外地老人受称赞](http://img35.house365.com/M00/E7/E0/rBEBa2FlWEuACod6AADmUPeJvd0032.jpg)