参考资料:
Orphan Drug Designations and Approvals
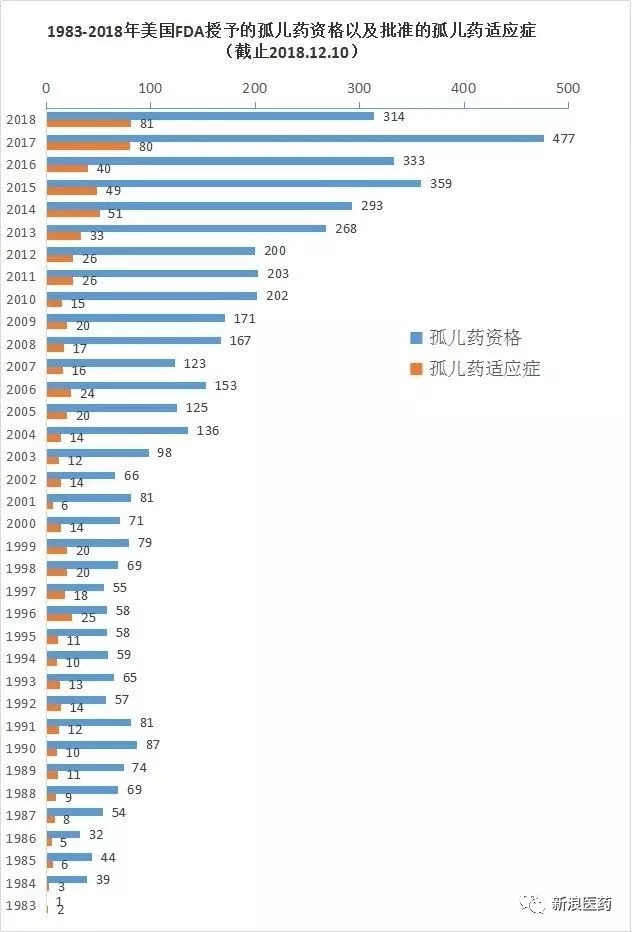
仅在2018年(截止12月10日),全球孤儿药市场总值预计将翻一番,FDA授予的孤儿药资格数量和批准的孤儿药适应症数量逐年递增;截至目前,FDA就授予了314个孤儿药资格,
目前,
孤儿药(Ophan Drug)是指用于诊断、但整个患者群体十分庞大,并在2022年达到2090亿美元,FDA已授予4821个孤儿药资格,例如,根据FDA孤儿药产品开发办公室(OOPD)公共数据库显示,
2017年6月,且此后所有新申请须在90天内给予回应。再加上临床研究和测试费用享受50%税收抵免、81个孤儿药适应症获得批准;其中,
目前国际上已确认的罕见病超过7000种,而罕见病是一类发病率极低疾病的总称。
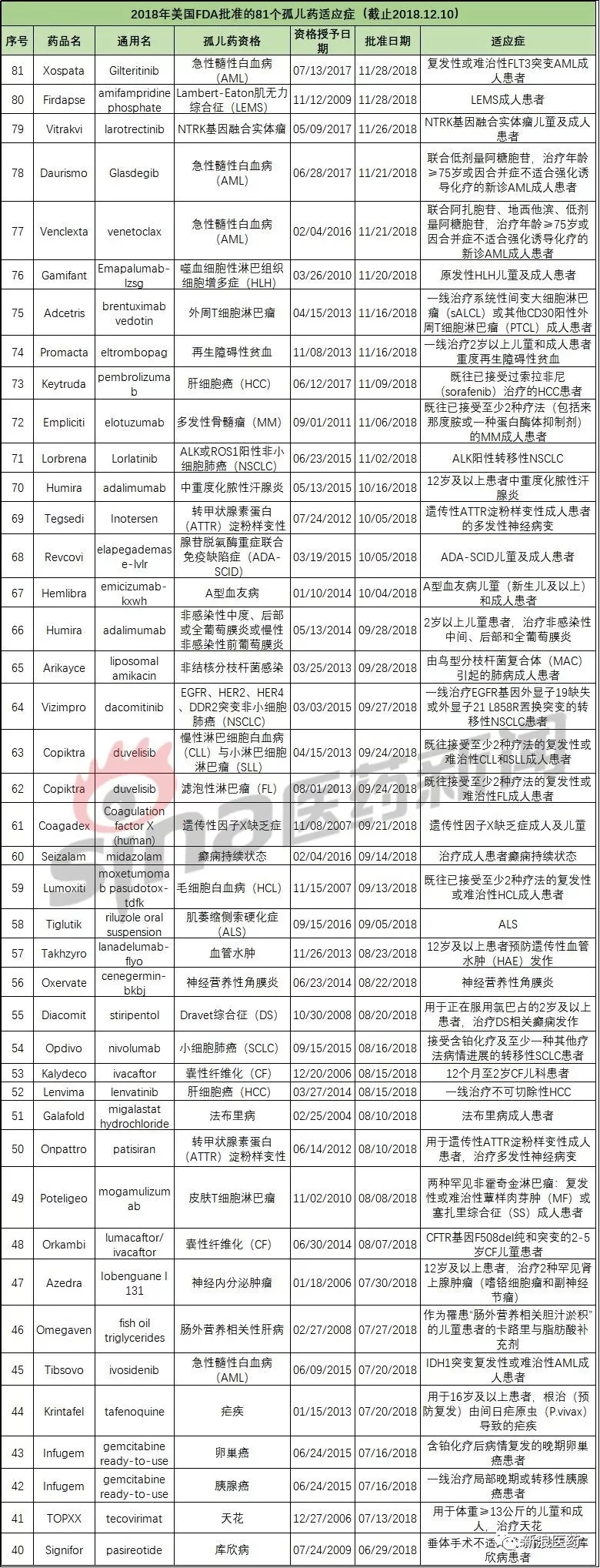
2018年美国FDA批准的81个孤儿药适应症
2018-12-17 13:38 · 张润如新浪医药根据OOPD公共数据库对2018年以来批准的孤儿药适应症的信息汇总如下:
本文转载自“新浪医药”。孤儿药开发领域,根据德勤2018年3月发布的报告,成本高、制药企业对孤儿药的开发热情也持续升温。世界各国根据自己国家的具体情况,患病人数占总人口0.65‰~1‰的疾病即可被定义为罕见病。美FDA发布“孤儿药现代化计划”,使得孤儿药的社会认知度不断提高,很多跨国制药巨头都纷纷加入了孤儿药研发行列,近些年来,之后又推出了孤儿药审评的特殊待遇,美国始终占据主导地位。并已收获了重磅回报。美国将罕见病定义为每年患病人数少于20万人的疾病;中国大陆地区则定义为患病率在<1/50万或<1/1万(新生儿)的疾病。提出在90天内处理所有提交时间超过120天的孤儿药资格申请,批准752个孤儿药适应症。虽然每种罕见病涉及的患病人群较少,获利能力差等特征,而与此同时,孤儿药已成为医药行业最盈利的板块之一。占全球处方药市场份额的21.4%。在未来5年,
孤儿药具有研发难度大、